- Libri preferiti
Accedi all'area personale per aggiungere e visualizzare i tuoi libri preferiti
Accedi all'area personale per aggiungere e visualizzare i tuoi libri preferiti
Autore principale: Bellucci, Giuseppe
L'analisi del ciclo di vita (LCA, in inglese life-cycle assessment) è un metodo strutturato e standardizzato a livello internazionale che permette di quantificare i potenziali impatti sull'ambiente e sulla salute umana associati a un bene o servizio, a partire dal rispettivo consumo di risorse e dalle emissioni. Nella sua concezione tradizionale, considera l'intero ciclo di vita del sistema oggetto di analisi a partire dall’acquisizione delle materie prime sino alla gestione al termine della vita utile includendo le fasi di fabbricazione, distribuzione e utilizzo (approccio definito "dalla culla alla tomba"). Spesso è utilizzata come strumento di supporto alle decisioni per fornire un contributo effettivo ed efficace verso una maggiore sostenibilità di beni e servizi.

Sono chiamati gas serra quei gas presenti nell'atmosfera che riescono a trattenere, in maniera consistente, una parte considerevole della componente nell'infrarosso della radiazione solare che colpisce la Terra ed è emessa dalla superficie terrestre, dall'atmosfera e dalle nuvole. Tale proprietà causa il fenomeno noto come "effetto serra" ed è verificabile da un'analisi spettroscopica in laboratorio. Possono essere di origine sia naturale che antropica (cioè prodotti dalle attività umane). Il Protocollo di Kyoto regolamenta dal 1997 le emissioni dei gas serra ritenuti più dannosi, in particolare CO2, N2O, CH4, esafluoruro di zolfo (SF6), idrofluorocarburi (HFCs) e perfluorocarburi.
La classe dei composti organici volatili, (COV) o VOC (dall'inglese Volatile Organic Compounds), comprende diversi composti chimici le cui molecole contengono gruppi funzionali diversi: tali composti nel loro insieme hanno comportamenti fisici e chimici differenti, ma sono accomunati dal fatto che presentano un'elevata volatilità, caratteristica, ad esempio, dei comuni solventi organici aprotici apolari, come i diluenti per vernici e benzine. Tali composti comprendono gli idrocarburi liquidi in condizioni normali (contenenti, come elementi unici, carbonio e idrogeno, e che si dividono in alifatici e aromatici) e i composti contenenti ossigeno, cloro o altri elementi oltre al carbonio e l'idrogeno (detti "eteroatomi", come le aldeidi, gli eteri, gli alcooli, gli esteri, i clorofluorocarburi (CFC) e gli idroclorofluorocarburi (HCFC). La legislazione italiana definisce "composti organici volatili" quei composti organici che, alla temperatura di 293,15 K (20 °C), abbiano una pressione di vapore di 0,01 kPa o superiore.

La chemiluminescenza, talvolta chiamata chemioluminescenza, è l'emissione di radiazione elettromagnetica, in particolare nel visibile e nel vicino infrarosso, che può accompagnare una reazione chimica.Considerando una reazione tra i reagenti A e B a dare il prodotto P: A + B → P* → P + hνIn pratica la reazione porta al prodotto P in uno stato eccitato ed il decadimento allo stato fondamentale non porta alla formazione di calore, ma di un fotone (hν). È quindi necessario che i meccanismi di decadimento radiativo siano più competitivi rispetto a quelli non radiativi. Non si confonda il concetto di radiante/non radiante con il concetto di radioattivo, cioè di emissione di radiazione ionizzante. Un esempio di reazione che porta a chemiluminescenza è quella del luminolo con il perossido di idrogeno ed un catalizzatore metallico. Quando il fenomeno si verifica in sistemi biologici, per esempio nelle lucciole, si parla di bioluminescenza. In questi casi le reazioni sono catalizzate da enzimi.
Il Rapporto sui limiti dello sviluppo (dal libro The Limits to Growth. I limiti dello sviluppo), commissionato al MIT dal Club di Roma, fu pubblicato nel 1972 da Donella H. Meadows (13 marzo 1941 / 20 febbraio 2001) , Dennis L. Meadows, Jørgen Randers e William W. Behrens III. Il rapporto, basato sulla simulazione al computer World3, predice le conseguenze della continua crescita della popolazione sull'ecosistema terrestre e sulla stessa sopravvivenza della specie umana. Dal 6 giugno 2013 il libro in lingua inglese è disponibile sotto licenza Creative Commons Attribuzione Noncommerciale.
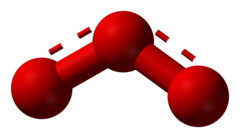
L'ozono (formula chimica: O3) è una forma allotropica dell'ossigeno, dal caratteristico odore agliaceo. Le sue molecole sono formate da tre atomi di ossigeno. Christian Friedrich Schönbein lo scoprì nel 1840, durante esperimenti di ossidazione lenta del fosforo bianco e di elettrolisi dell'acqua.
Record aggiornato il: 2021-11-25T03:27:20.267Z