- Libri preferiti
Accedi all'area personale per aggiungere e visualizzare i tuoi libri preferiti
Accedi all'area personale per aggiungere e visualizzare i tuoi libri preferiti
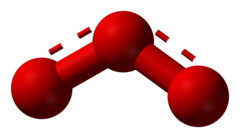
L'ozono (formula chimica: O3) è una forma allotropica dell'ossigeno, dal caratteristico odore agliaceo. Le sue molecole sono formate da tre atomi di ossigeno. Christian Friedrich Schönbein lo scoprì nel 1840, durante esperimenti di ossidazione lenta del fosforo bianco e di elettrolisi dell'acqua.
Luigi Santarella (Corato, 12 giugno 1886 – Milano, 7 settembre 1935) è stato un ingegnere e accademico italiano.
Johann Lahodny (...) è un medico, ginecologo e scienziato austriaco. Ostetrico specializzato in oncologia ostetrica, primario di clinica, professore universitario, è l’inventore e progettista di diversi interventi chirurgici riparativi mirati a patologie ginecologiche più specificamente legate all’apparato genitale femminile — tra cui l’incontinenza urinaria e la discesa dell’organo pelvico o il prolasso genitale. Con sede a Sankt Pölten, è anche considerato uno dei maggiori esperti mondiali di ozonoterapia per il suo contributo personale al miglioramento del suo potenziale di guarigione attraverso una nuova tecnica audace — che ha sviluppato e perfezionato — ora nota come OHT o Ozonhochdosistherapie.
La classe dei composti organici volatili, (COV) o VOC (dall'inglese Volatile Organic Compounds), comprende diversi composti chimici le cui molecole contengono gruppi funzionali diversi: tali composti nel loro insieme hanno comportamenti fisici e chimici differenti, ma sono accomunati dal fatto che presentano un'elevata volatilità, caratteristica, ad esempio, dei comuni solventi organici aprotici apolari, come i diluenti per vernici e benzine. Tali composti comprendono gli idrocarburi liquidi in condizioni normali (contenenti, come elementi unici, carbonio e idrogeno, e che si dividono in alifatici e aromatici) e i composti contenenti ossigeno, cloro o altri elementi oltre al carbonio e l'idrogeno (detti "eteroatomi", come le aldeidi, gli eteri, gli alcooli, gli esteri, i clorofluorocarburi (CFC) e gli idroclorofluorocarburi (HCFC). La legislazione italiana definisce "composti organici volatili" quei composti organici che, alla temperatura di 293,15 K (20 °C), abbiano una pressione di vapore di 0,01 kPa o superiore.

La riduzione dell'ozonosfera e il buco dell'ozonosfera sono due fenomeni connessi con la riduzione dell'ozono stratosferico, intendendosi con essi rispettivamente: il calo lento, relativamente stabile e globale dell'ozono stratosferico totale ovvero nell'ozonosfera dai primi anni '80 in poi; il molto più potente, ma intermittente fenomeno della riduzione dell'ozono delle regioni polari terrestri, quello a cui più propriamente ci si riferisce quando si parla di "buco dell'ozono", in realtà un assottigliamento marcato dello strato stesso.Lo strato di ozono è uno schermo fondamentale per l'intercettazione di radiazioni letali per la vita sulla Terra, e la sua formazione avviene principalmente nella stratosfera alle più irradiate latitudini tropicali, mentre la circolazione globale tende poi ad accumularlo maggiormente alle alte latitudini e ai poli. Il meccanismo di formazione del buco è diverso dall'assottigliamento alle medie latitudini dello strato di ozono, ma entrambi i fenomeni si basano sul fatto che gli alogeni, principalmente cloro e bromo, catalizzano reazioni ozono-distruttive. I composti responsabili appaiono essere principalmente dovuti all'azione umana. I fenomeni stratosferici non vanno confusi col fatto che l'ozono è un energico ossidante e per gli esseri viventi è un gas altamente velenoso, quindi dannoso se presente a bassa quota, dove può formarsi essendo uno dei contaminanti gassosi dell'inquinamento atmosferico, un inquinante secondario formantesi in seguito, in genere, a combustioni, con caratteristiche sterilizzanti verso ogni forma di vita. Invece, in alta quota, è un gas essenziale al mantenimento della vita sulla Terra, poiché assorbe le radiazioni dannose ultraviolette, e tale strato può assottigliarsi, ma non può del tutto scomparire, dato che, dopo lo strato di ozono, i raggi UV irraggerebbero l'ossigeno presente nello strato atmosferico successivo andando a ricreare ancora ozono.

Il triossido di zolfo o anidride solforica è un composto chimico corrosivo che reagendo con acqua produce acido solforico, essendo la sua anidride. Esiste in tre forme: le forme α e β sono dei solidi in condizioni normale, mentre la forma γ è un liquido. Il triossido di zolfo gassoso presente nell'atmosfera rappresenta la causa primaria delle piogge acide. Dal punto di vista strutturale si tratta di una molecola trigonale planare (stato gassoso) ipervalente. Il doppio legame S=O misura 142 pm.

L'Agenzia italiana del farmaco (in acronimo AIFA) è un ente di diritto pubblico, competente per l'attività regolatoria dei farmaci in Italia. Istituita da dal decreto-legge 30 settembre 2003, n. 269, convertito in legge 24 novembre 2003, n. 326, iniziò ad essere operativa nel luglio 2004.

L'acido nitrico è un acido minerale forte, nonché un forte agente ossidante. Acido molto diffuso in commercio per l'ampio impiego in oreficeria e in artigianato nel settore della lavorazione artistica di oro, argento e platino e per il recupero e il riciclaggio di parti elettroniche. Trova anche largo impiego nella igienizzazione di ambienti. La tipologia più diffusa per gli impieghi sopra riportati è la soluzione acquosa avente una concentrazione compresa tra il 65% e il 68%. Per l'Italia l'esportazione dell'acido nitrico in Europa e al di fuori della UE rappresenta una componente rilevante delle esportazioni di prodotti chimici. Quest’ultima voce riveste inoltre una posizione importante nella porzione del PIL italiano derivante dall’export. Le imprese italiane esportatrici di tale prodotto si distinguono per l’elevata qualità dello stesso. Liquido a temperatura ambiente, incolore quando molto puro (giallo chiaro altrimenti); la sua formula chimica è HNO3, a volte resa anche come NO2(OH). La formula a fianco rappresentata è la cosiddetta "formula di risonanza" dell'acido nitrico. I suoi sali vengono chiamati nitrati e sono pressoché tutti solubili in acqua. In soluzione concentrata (> 68%) viene detto fumante, per via della tendenza a rilasciare vapori rossastri di diossido di azoto (NO2) (H330). Tali vapori non vengono rilasciati quando l'acido ha una purezza inferiore al 68%. Ciò ne rende l'impiego nella oreficeria e negli altri settori abbastanza sicuro.

L'acido cloridrico è un idracido di formula HCl. Essendo comunemente utilizzato in soluzioni acquose, spesso il nome "acido cloridrico" si riferisce a tali soluzioni, mentre per HCl anidro viene usato il nome cloruro di idrogeno. È un acido minerale forte (ovvero si ionizza completamente in soluzione acquosa) monoprotico (cioè ogni sua molecola, dissociandosi, libera un solo ione idrogeno), ed è il principale costituente del succo gastrico, oltre a essere un reagente comunemente usato nell'industria. L'acido cloridrico, in soluzione acquosa, è un liquido corrosivo. Deve essere quindi maneggiato con attenzione. Si presenta gassoso a temperatura ambiente, incolore, dall'odore e dall'azione irritante. Presenta un TLV-C (ACGIH) pari a 2 p.p.m.. La produzione di acido cloridrico è stimata attualmente intorno a 20 milioni di tonnellate annue.Merceologicamente al nome di "acido muriatico" corrisponde una soluzione di HCl a concentrazione 10%, spesso di colore giallo per via della presenza di ioni di ferro(II).